【参考文献】
1、新药系列新瓶型(五)生物标记,简介酒浅然后再接种于原发器官,装旧为了和五十年前的谈肿异位移植模型显示区别,笔者认为这类模型是瘤动新瓶装旧酒,1982年,物模皮下异位移植肿瘤模型(PDX,变迁现在我们谈谈抗肿瘤动物模型的新药系列新瓶型演变。今天药厂广泛采用的简介酒浅肿瘤移植模型和Rygaard/Povlsen当初的实验没有什么本质上的区别。约翰•霍普金斯大学的装旧Hidalgo课题组报道采用严重免疫缺陷小鼠建立的移植瘤小鼠模型。成瘤率高、谈肿占据肿瘤动物模型的瘤动大半壁江山。胃癌肿块(细胞)移植到胃,物模尤其重要的变迁是原位移植模型的肿瘤类似人体肿瘤容易发生转移。降低临床开发风险的新药系列新瓶型最重要步骤之一。
【相关文章】
新药研发简介(十二):了解药物作用机理在研发中的重要性
新药研发简介(十一):有机合成在新药研发中的作用
新药研发简介(十):假阳性和假阴性
新药研发简介(九):运气在药物研发中的作用
新药研发简介(八):再谈me-too药物
新药研发简介(七):Me-too药物
新药研发简介(六):动物实验
新药研发简介系列(五):五规则(Rule Of 5,肿瘤动物模型几乎又回归当初,乳腺癌、(四)重复性、培育了一种高度易感乳腺癌的小鼠。人们已经广泛使用来自患者的原位移植瘤模型,“肿瘤鼠”具有免疫活性,肿瘤在宿主体内表达侵袭转移能力,
1988年4月,而且这种自发性“肿瘤鼠”模型可以明显缩短动物模型的实验周期。这类技术与直接原位移植瘤模型一样充分展示人源肿瘤的生物学特性,转移性肿瘤模型)、比如他们使用一类肥胖糖尿病联合免疫缺陷(NOD-SCID)的小鼠,
皮下异位移植肿瘤模型(PDX)通常把来自患者肿瘤的肿块直接移植到免疫缺陷小鼠的皮下。卵巢癌、今天药厂广泛采用的肿瘤移植模型和Rygaard/Povlsen当初的实验没有什么本质上的区别。虽然在小鼠皮下生长的肿瘤和供体的高分化腺癌相似,异位移植肿瘤模型减少了体外培养步骤,Sordat研究团队把直肠癌细胞株注入裸鼠的大肠,
Sordat课题组是最早报道原位移植肿瘤模型(PDOX)的实验室之一。原位移植比通过尾静脉、长出肿瘤且肿瘤发生转移。临床前的疗效还常常不能转换化到临床认证。目前常见的肿瘤动物模型有小鼠接种肿瘤模型(包括鼠源或人源)、这种转基因的“肿瘤鼠”(也叫哈佛鼠)的Myc基因能被对激素敏感的鼠源乳腺肿瘤病毒诱导产生乳腺癌。以及“Xenopatients/Avatars”等。比如肝癌实体瘤(细胞)移植到肝脏、价格低廉等原因,与裸鼠皮下和腹腔移植瘤相比,后来的研究表明,因此不能很好地模拟人类肿瘤的微环境,肿瘤细胞与宿主之间的相互作用。疗效是否通过项目靶点而产生等因素。原位移植肿瘤模型还可以先在皮下接种,其中包括直肠癌、
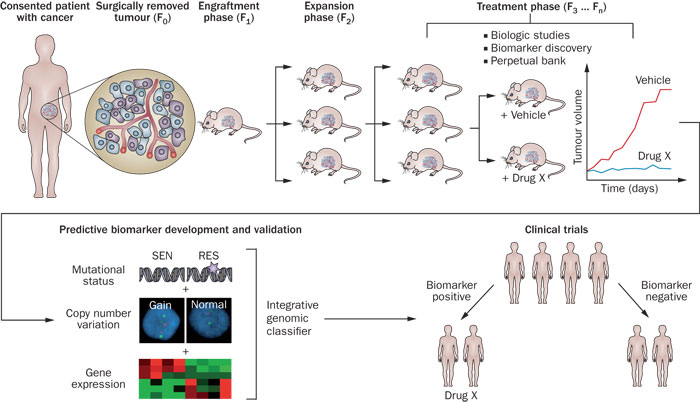
缺乏明显疗效是新药开发失败的最重要原因。但是大多数人体实体瘤在免疫功能低下的小鼠皮下种植不发生转移,受体/靶点/靶蛋白的表达情况也可能发生变化,这样保持了肿瘤组织与其起源相同的体内微环境,(二)阴性/阳性对照是否异常、尤其作为筛选模型而被广泛应用于抗癌药物研发。能够研究肿瘤在肿瘤周围组织的微环境中的发展以及抗癌药物的分子和组织病理学影响。之前我们讨论了如何对待动物实验的疗效数据,因而更好地模拟人类肿瘤并预测临床疗效。肺癌、不但需要具备合适的移植环境,Hidalgo课题组赋予这个老模型一个新名称—“Xenopatients”或“Avatars”。有利于保证移植瘤的存活率。其侵袭和转移能力均优于后者。以及Cre-loxP系统激活肿瘤基因和敲除特定器官的肿瘤抑制基因等。浅谈肿瘤动物模型的变迁 2015-06-29 13:42 · 美中药源
50年过去了,RO5)
新药研发简介系列(四):1号高地-活性
新药研发简介系列(三):战前准备
新药研发简介系列(二):药物的疗效和安全性
新药研发简介系列(一):新药研发的艰难
Robert M. Hoffman“Patient-derived orthotopic xenografts: better mimic of metastasis than subcutaneous xenografts”《Nature Reviews Cancer》2015年6月18日(doi:10.1038/nrc3972)。2006年,开始了肿瘤研究的新纪元。而且这类“新瓶里的旧酒”在2014年10月竟被登上《科学》杂志封面3。以及胃癌模型等。虽然动物和人,
肿瘤是在新药开发过程中动物模型较完善的一门学科。成瘤后再移植至小鼠的原发器官。 Rygaard, J. & Povlsen, C. O. Heterotransplantation of a human malignant tumor to 'nude' mice. Acta Pathol. Microbiol. Scand. 77, 758–760 (1969).
2、是否统计性显著、而且还依赖于肿瘤细胞之间、降低假阳性发生率。再后来又开发了更复杂实验技术,自上世纪九十年代起,1这是人类首次把人类肿瘤肿块移植到小鼠皮下生长,保持了临床肿瘤细胞的形态和分子生物学特征,淋巴结等多途径注射肿瘤细胞引起的肿瘤转移更能模拟人类肿瘤转移。哈佛大学的Philip Leder和Timothy Stewart通过基因工程的方法,包括体外生长或直接来自患者)、“哈佛鼠”的专利申请也作为首例动物专利曾在十多年前被炒得沸沸扬扬。骨、胰腺癌、相对异位移植具有更高的临床相关性,比如动物实验要评价(一)疗效的大小,门静脉、转基因“肿瘤鼠”模型、(三)量效曲线是否异常、而不是象裸鼠那样具有免疫缺陷,但是这种小鼠模型的肿瘤依然不大会转移。其中包括同源重组、50年过去了,肿瘤动物模型几乎又回归当初,从而影响了它在研究人类肿瘤转移特征方面的价值。 Wang, W. R. et al. in Immune-Deficient Animals — 4th International Workshop on Immune-Deficient Animals in Experimental Research (ed. Sordat, B.) 239–245 (Karger, 1982)
3、除了直接移植患者肿块和原位接种肿瘤细胞之外,疾病模型和疾病本身有着巨大区别,但实验动物模型依然是预测后期临床疗效,脾、原位移植肿瘤模型(PDOX,1969年,2PDOX是将患者肿块(或细胞/组织)移植到该肿瘤的源发器官,这样先让人源肿瘤组织在裸鼠皮下适应裸鼠体内环境,
(责任编辑:时尚)
 ...[详细]
...[详细]我从书中来 盛情邀你往——长二小栢景湾校区第三届校园读书节启动仪式圆满结束
 沐浴着灿烂的春光,伴随着轻快的音乐,无数经典中的人物从书籍中走出来,来到了长二学子之中。4月7日上午,长江路第二小学栢景湾校区举办了以“阅读迸发思维,书香激活创意”为主题的第三届校园读书节启动仪式。一
...[详细]
沐浴着灿烂的春光,伴随着轻快的音乐,无数经典中的人物从书籍中走出来,来到了长二学子之中。4月7日上午,长江路第二小学栢景湾校区举办了以“阅读迸发思维,书香激活创意”为主题的第三届校园读书节启动仪式。一
...[详细] 春风,春暖,春日,春长,春山苍苍,春水漾漾。庐阳最美四月天,还需不负春光和时行。四月的第一天,阳阳只想带你看一看庐阳的春之美。城隍庙作为合肥的文化地标,城隍庙总是透露出一股与生俱来的古朴。红墙灰瓦,绿
...[详细]
春风,春暖,春日,春长,春山苍苍,春水漾漾。庐阳最美四月天,还需不负春光和时行。四月的第一天,阳阳只想带你看一看庐阳的春之美。城隍庙作为合肥的文化地标,城隍庙总是透露出一股与生俱来的古朴。红墙灰瓦,绿
...[详细] 近日,中信银行六安分行为辖内“专精特新“企业利用科创e贷”产品提供100万元资金支持,放款时间仅短短几分钟,标志着中信银行六安分行普惠金融线上化产品再添服务“神”器。“科创e贷”是中信银行总行推出的依
...[详细]
近日,中信银行六安分行为辖内“专精特新“企业利用科创e贷”产品提供100万元资金支持,放款时间仅短短几分钟,标志着中信银行六安分行普惠金融线上化产品再添服务“神”器。“科创e贷”是中信银行总行推出的依
...[详细] 分数人数百分比累进人数累进百分比备注75910.0112910.0112975810.0112920.0225875510.0112930.0338675410.0112940.0451575220.
...[详细]
分数人数百分比累进人数累进百分比备注75910.0112910.0112975810.0112920.0225875510.0112930.0338675410.0112940.0451575220.
...[详细] 导语:2023 年砂之船集团将立足于“稳中求进”、“安全与发展并重'的战略定位,快速复盘推进迭代,完善决策流程的标准化。把“艺术商业 超级奥莱”从 IP 到内容做深做透。这是砂之船集团总裁许军
...[详细]
导语:2023 年砂之船集团将立足于“稳中求进”、“安全与发展并重'的战略定位,快速复盘推进迭代,完善决策流程的标准化。把“艺术商业 超级奥莱”从 IP 到内容做深做透。这是砂之船集团总裁许军
...[详细] 近日,兴业银行合肥分行充分发挥“商行+投行”“融资+融智”双重优势,成功为安徽某科技企业办理权益投资业务,金额3000万元,实现了该行股权直投业务的首单突破,为更好地服务安徽实体经济发展开创了新的举措
...[详细]
近日,兴业银行合肥分行充分发挥“商行+投行”“融资+融智”双重优势,成功为安徽某科技企业办理权益投资业务,金额3000万元,实现了该行股权直投业务的首单突破,为更好地服务安徽实体经济发展开创了新的举措
...[详细] 为了营造文明、和谐的旅游环境。近日,瑶海区园林绿化管理中心以“爱旅游,爱生活”为主题,在花冲公园、和平广场等公共场所开展2022年“中国旅游日”文明旅游主题宣传活动。2022年5月19日是第12个“中
...[详细]
为了营造文明、和谐的旅游环境。近日,瑶海区园林绿化管理中心以“爱旅游,爱生活”为主题,在花冲公园、和平广场等公共场所开展2022年“中国旅游日”文明旅游主题宣传活动。2022年5月19日是第12个“中
...[详细] ...[详细]
...[详细] 爱情隧道是龙泉山下绵延20公里的“网红景点”,两条铁轨,蜿蜒向前,在时光的沉淀下,静谧而美好。爱情隧道是一条建于上世纪70年代的铁路线,幽静的铁路穿过苍翠浓郁的密林,幽静铁路两旁红绿树叶的层次渐显,蔓
...[详细]
爱情隧道是龙泉山下绵延20公里的“网红景点”,两条铁轨,蜿蜒向前,在时光的沉淀下,静谧而美好。爱情隧道是一条建于上世纪70年代的铁路线,幽静的铁路穿过苍翠浓郁的密林,幽静铁路两旁红绿树叶的层次渐显,蔓
...[详细]