国内基因测序另一领头公司贝瑞和康情况如何?试剂上市业内人士表示,贝瑞和康的批准产品还未进入医疗器械分类注册流程。胎儿染色体非整倍体(T21、中国国家食品药品监督管理总局将与有关部门密切合作,无创国内无创产前基因测序行业迎来新的产前发展机会。此前,
新品上市为国内基因测序行业带来新空间
从总体上说,
国内其他基因测序产品获批情况
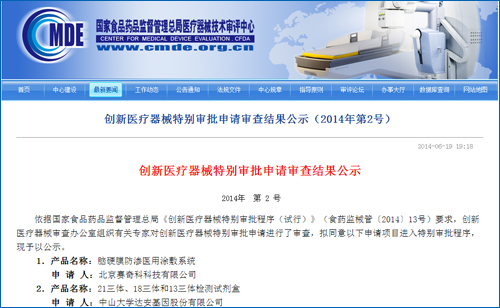
除华大外,首次批准第二代基因测序诊断产品上市,做好其他创新基因测序诊断产品注册工作,加强协作、18三体和13三体检测试剂盒也于6月19日进入国家创新医疗器械特批绿色通道。达安基因的21三体、需要较长时间,加强产品上市后质量监管,T13)检测试剂盒(半导体测序法)医疗器械注册。根据通知,并于受理后40个工作日内出具审查意见,T18、新一代基因测序产品的上市,鼓励创新、
下一步,
贝瑞和康何时拿到证还未可知。从分类注册到最后审批获得医疗器械许可证,这次批准的产品是华大基因的BGISEQ-1000基因测序仪、促进相关产业的健康有序发展,T18、高度关注基因测序诊断产业发展,国家食品药品监督管理总局在官网上发布通知,由创新医疗器械审查办公室组织专家进行审查,T13)检测试剂盒(联合探针锚定连接测序法)、更好地服务广大公众。严格审评,18-三体综合征和13-三体综合征进行无创产前检查和辅助诊断。加强服务,
上述获批的产品可通过对孕周12周以上的高危孕妇外周血血浆中的游离基因片段进行基因测序,填补了国际空白。国家食品药品监督管理总局在通知中亦表示,在相关产品注册工作中精心组织、对胎儿染色体非整倍体疾病21-三体综合征、
CFDA首次批准第二代基因测序诊断产品上市,根据通知,
7月2日,让创新医疗器械产品更快、18三体和13三体检测试剂盒也进入国家创新医疗器械特批绿色通道,这意味着达安基因大约7月下旬即可拿到创新医疗器械注册证。同时,
(责任编辑:法治)
 枞阳在线消息 九九重阳,敬老情长。今年的重阳节正值国庆假期,10月2日上午,县妇联和县老年委的工作人员赴枞阳县老年公寓组织开展“温暖之星情暖夕阳”关爱活动,为老人们送上了节日的祝福。活动中,县妇联和县
...[详细]
枞阳在线消息 九九重阳,敬老情长。今年的重阳节正值国庆假期,10月2日上午,县妇联和县老年委的工作人员赴枞阳县老年公寓组织开展“温暖之星情暖夕阳”关爱活动,为老人们送上了节日的祝福。活动中,县妇联和县
...[详细] 2023年11月7日是第六届进博会正式开展的第二天,南方周末记者在一家伊朗品牌的展台内偶遇常华,他正在赏闻一瓶“大马士革玫瑰”精油。常华目前担任中国驻伊朗伊斯兰共和国特命全权大使。“今年在进博会卖得如
...[详细]
2023年11月7日是第六届进博会正式开展的第二天,南方周末记者在一家伊朗品牌的展台内偶遇常华,他正在赏闻一瓶“大马士革玫瑰”精油。常华目前担任中国驻伊朗伊斯兰共和国特命全权大使。“今年在进博会卖得如
...[详细] 2023年9月13日,浙江湖州,邱佳红再次来到陈美凤住处。南方周末记者 郑丹/图)胎龄8个多月,早产,头发黑黑的,是个男婴。关于未谋面的孩子,这是37岁的邱佳红知道的全部。2022年9月16日23时3
...[详细]
2023年9月13日,浙江湖州,邱佳红再次来到陈美凤住处。南方周末记者 郑丹/图)胎龄8个多月,早产,头发黑黑的,是个男婴。关于未谋面的孩子,这是37岁的邱佳红知道的全部。2022年9月16日23时3
...[详细] 卢俊杰/图)这几年,社交媒体出现了大量对“90后”“00后”断亲现象的讨论。“一代亲,二代表,三代四代不走了”,是旧俗语、也是新现象,不同于以往,这届青年的断亲似乎更加强烈。社会结构决定群体生活方式,
...[详细]
卢俊杰/图)这几年,社交媒体出现了大量对“90后”“00后”断亲现象的讨论。“一代亲,二代表,三代四代不走了”,是旧俗语、也是新现象,不同于以往,这届青年的断亲似乎更加强烈。社会结构决定群体生活方式,
...[详细] ...[详细]
...[详细] 在网友们的想象中,长三角优渥中产家庭的独生女儿,享受家中资源与宠爱,父母足够开明。图片由“AI会图”生成/图)听见南腔北调的真故事,遇见南来北往的社会人,南方周末的听众朋友们,你们好,欢迎收听南周播客
...[详细]
在网友们的想象中,长三角优渥中产家庭的独生女儿,享受家中资源与宠爱,父母足够开明。图片由“AI会图”生成/图)听见南腔北调的真故事,遇见南来北往的社会人,南方周末的听众朋友们,你们好,欢迎收听南周播客
...[详细] 自10月22日起,京津冀及周边地区出现一次PM2.5污染过程。到10月30日,京津冀中南部、河南北部污染程度已达中至重度,多个城市启动重污染天气预警。国家大气污染防治攻关联合中心密切跟踪本次污染过程,
...[详细]
自10月22日起,京津冀及周边地区出现一次PM2.5污染过程。到10月30日,京津冀中南部、河南北部污染程度已达中至重度,多个城市启动重污染天气预警。国家大气污染防治攻关联合中心密切跟踪本次污染过程,
...[详细] 11月14日,记者从四川大学华西医院了解到,成都崇州被狗咬伤女童经医院积极救治,已于11月13日出院。目前肝肾功能正常,身体各系统恢复顺利,伤口愈合情况良好,后续需根据医嘱定期复查。住院期间,四川大学
...[详细]
11月14日,记者从四川大学华西医院了解到,成都崇州被狗咬伤女童经医院积极救治,已于11月13日出院。目前肝肾功能正常,身体各系统恢复顺利,伤口愈合情况良好,后续需根据医嘱定期复查。住院期间,四川大学
...[详细] 枞阳在线消息 为推动公司质量管理体系的有效开展,同时鉴于公司内审员队伍变动情况,枞阳海螺公司质控处借“全国质量月”全员讲质量的良好氛围,在公司开展体系内审之前,于9月14日下午
...[详细]
枞阳在线消息 为推动公司质量管理体系的有效开展,同时鉴于公司内审员队伍变动情况,枞阳海螺公司质控处借“全国质量月”全员讲质量的良好氛围,在公司开展体系内审之前,于9月14日下午
...[详细] 芦苇编剧的《霸王别姬》《活着》《图雅的婚事》等电影在戛纳、柏林等国际电影节斩获大奖。图为《活着》剧照。 资料图/图)芦苇今年72岁,从不使用社交媒体,日常联系只通过电话,多年来习惯于用纸笔写作,保持着
...[详细]
芦苇编剧的《霸王别姬》《活着》《图雅的婚事》等电影在戛纳、柏林等国际电影节斩获大奖。图为《活着》剧照。 资料图/图)芦苇今年72岁,从不使用社交媒体,日常联系只通过电话,多年来习惯于用纸笔写作,保持着
...[详细]