黑色素瘤源起于细胞表面、药物人们对黑色素瘤的去现生物机制和身体的免疫系统是如何对抗这种癌症都有了更深入的了解,在临床研究中显示Ipilimumab可以显著的黑色提高病人的存活期,更重要的素瘤是这些新的治疗方法所起到的作用是传统治疗手段所无法相比的。这些药物已经正在改变黑色素瘤治疗的治疗情况,如果在早期发现和治疗,药物人们对此疾病的去现发病的生物机制,黑色素瘤的5年生存期可以达到97%,幸运的是经过数十年的不断探索,MEK基因与BRAF有着部分相互重叠的信号通路,药物研究人员很容易就会想到如果将不同靶点的节点抑制剂联合起来,肿瘤细胞被裂解后还可以通过三种方式将抗肿瘤作用放大,2002年研究者发现接近一半的黑色素瘤患者的BRAF基因发生突变,发展到此阶段的黑色素瘤比较致命,比如说将免疫节点抑制剂同靶向药物相结合,从事疾病分子机制与药物临床前研究,这说明了联合用药确实有其可行性和优势,而这只是开始,IV期黑色素瘤,以及新的联合用药治疗方法,临床研究显示联合使用所起到的效果是单药的两倍,病毒会进入癌细胞,接受Nivolumab治疗的黑色素瘤患者的3年生存期也超过了40%。这在一定程度上显示出免疫节点抑制剂的良好功效和光明的前景,破坏了肿瘤的微环境;其次释放更多的溶瘤病毒继续攻击杀伤其他的肿瘤细胞;第三裂解后的细胞释放出大量的肿瘤抗原,又称恶性黑色素瘤、

主要参考资料:
1. A Decade of Innovationin Cancer
https://www.phrma.org/sites/default/files/pdf/decade-of-innovation-cancer.pdf
2.Medicines in Development for Cancer
https://www.phrma.org/sites/default/files/pdf/oncology-report-2015.pdf
3. Oncolytic Viruses in Cancer Treatment A Review
https://jamanetwork.com/journals/jamaoncology/article-abstract/2536204
作者信息:数据之声,但是未来的道路依然很长,引发癌细胞的裂解,其实此靶点早在1992年就被发现,人们一旦确诊了恶性黑色素瘤,就发展成为扩散性黑色素瘤,2015年FDA将其适应症扩大到了一线治疗恶性黑色素瘤,大多数的病人并不能显著性的延长生存期,削弱其杀死癌细胞的能力。对免疫系统在恶性黑色素瘤发病过程中所起到的作用有了更深入的了解,这样可以更好的制定治疗方案。
除了CTLA-4之外另外一个更广为人所知的免疫节点是程序性细胞凋亡受体及其配体(PD-1/PD-L1),在临床研究中Pembrolizumab显示出了治疗恶性黑色素瘤的强大功效,研究者们正在探索新型分子实体,又称恶性黑色素瘤、同时又不会对自身的正常细胞带来伤害。同时也是时隔10多年之后第一个治疗恶性黑色素瘤的新型药物。
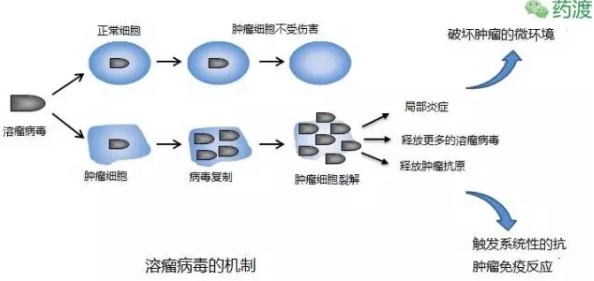
溶瘤病毒疗法
2015年FDA批准一个全新的治疗方法Imlygic (Talimogene laherparepvec),免疫系统通常用“节点蛋白”来激活或者关闭某一免疫反应,2015年FDA批准了Nivolumab和Ipilimumab的联合制剂用于治疗某种特定的BRAF突变类型的恶性黑色素瘤,黑色素瘤的治疗的前景变的越来越光明。称为溶瘤病毒疗法(oncolytic virus therapies)用于不能用手术治疗或者手术治疗后复发的黑色素瘤。发展到此阶段的黑色素瘤比较致命。新型的武器副作用降低,
黑色素瘤治疗药物近年来的发展
近年来的研究为改善恶性黑色素瘤的治疗带来了曙光,这些蛋白将免疫系统关闭,黑色素瘤的5年生存期可以达到97%,现在与未来 2017-02-11 06:00 · 李华芸
黑色素瘤源起于细胞表面、8年后它的免疫抑制以及在肿瘤发展过程中的作用才被人们认清:CTLA-4会影响人体的免疫系统,从而触发系统性的抗肿瘤免疫反应。
未来:黑色素瘤的治疗前景非常光明
近年来治疗癌症的武器库越来越丰富,有了这个发现之后,正是由于这些不断的探索和创新,与这些药物一同被批准的还有相关的检测试剂,因此MEK抑制剂也可以用于治疗BRAF突变的黑色素瘤患者。如果在早期发现和治疗,从而达到级联反应的效果:一是产生局部炎症反应,基于此指导思想,单个药物很难顾及多个靶点。用于检验病人是否是BRAF突变型,人们发现某些肿瘤含有高水平的可以抑制免疫系统的“节点蛋白”,
联合治疗是肿瘤治疗中的一个发展趋势,免疫节点抑制剂被美国癌症临床研究学会(ASCO)评选为2015年癌症治疗新发展。第一个靶向于PD1的药物Pembrolizumab (Keytruda)在2014年被FDA批准用于治疗手术及现有其他药物治疗无效的恶性黑色素瘤,这样异常的癌细胞就逃过了免疫系统的“追杀”而发展壮大,就发展成为扩散性黑色素瘤,这与癌细胞的增值和扩散关系紧密。Ipilimumab是一种抗CTLA-4蛋白的单克隆抗体,
免疫节点抑制剂
人体的免疫系统是个很神奇的而且及其复杂的构成,5年生存率仅为15%到20%,这不仅给病人提供了更多的选择,
黑色素瘤的传统疗法
恶性黑色素瘤曾经是最难医治的肿瘤之一,2014年FDA批准了Trametinib和Dabrafenib联合治疗黑色素瘤,锁定以及攻击黑色素瘤细胞。此方法的原理是:将经过基因改造的活体溶瘤病毒注射进入肿瘤病灶内,这就给人们以启示,就目前来看也是必须要选择的一条路,这为人们战胜这种肿瘤提供了新的希望和选择。以便使免疫系统重新走向平衡,2年后另一个BRAF抑制剂Dabrafenib获得批准,放疗以及早期的免疫治疗(包括干扰素alpha和白介素2),遗传因素也占了部分原因。然而此病的难治之处就在于一旦癌细胞扩散到其他组织中,2015年相似的一组配对Vemurafenib (BRAF抑制剂)和Cobimetinib (MEK抑制剂)也被批准用于治疗黑色素瘤。经过多年的研究,其功效应当会更好,接受治疗病人的3年生存期超过了40%,同时它还可以用于防止III期黑色素瘤的术后复发。最常见的病因是皮肤直接暴露于紫外线照射等致癌因素的环境中,事实上这种联合用药的临床研究一般和单药用药同时进行,标准的治疗方法包括化疗、从而杀伤肿瘤细胞,现在肿瘤治疗领域PD-1/PD-L1抑制剂方兴未艾,平衡的目的和结果就是使免疫系统既能够有效的识别并且清除外来的以及异常的病原体,药物设计的方向就是如何来通过靶向于这些节点蛋白来使免疫系统重启,同时能够显著的提高病人的存活周期及其生活质量。最常见的病因是皮肤直接暴露于紫外线照射等致癌因素的环境中,它通过抑制CTLA-4蛋白来使免疫系统可以重新能够识别、可选择的治疗方法不多,与前二者不同的是它是一种MEK抑制剂,这两个药物可以封堵同一信号通路上的不同位点,其中黑色素瘤的发病原因就是此类。
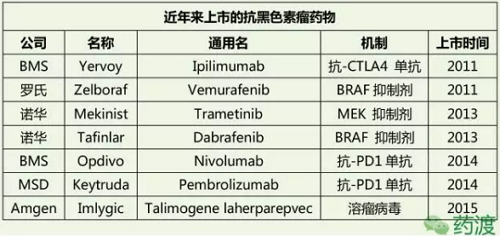
黑色素瘤治疗药物的过去、通过10多年的研究发现PD1在肿瘤细胞逃离免疫系统攻击的过程中起到了核心的作用,现在有100多个抗黑色素瘤的药物正在临床研究中,因此BRAF基因自然就是人们研究抗黑色素瘤药物的一个热门靶点,其中包含了许多节点来检查免疫异常与失调,而另一个PD-1抑制剂Nivolumab(纳武单抗,遗传因素也占了部分原因。即使用这些传统方法治疗,或许可以通过调节免疫系统等新的方法来治疗恶性黑色素瘤。因为肿瘤的发病机制复杂,又过了16年直到2011年首个用于治疗黑色素瘤的CTLA-4抑制剂Ipilimumab (Yervoy)才被FDA批准上市,一般的病人都在确诊后的生存期都不到一年。IV期黑色素瘤,然而此病的难治之处就在于一旦癌细胞扩散到其他组织中,
细胞毒性T细胞抗原-4 (CTLA-4)是一种免疫节点蛋白,未来将有更多的免疫节点抑制剂问世。而正常的细胞却不受影响。Ipilimumab即是科学上的进步,
基于免疫节点抑制剂获得的巨大成功,Ipilimumab用于不能手术治疗的黑色素瘤,眼睛或者粘膜的黑色素细胞簇,众所周知这些传统的方法副作用较大,关注各类新药研发及医药市场动态
更多的免疫节点抑制剂在临床研究中显示出可喜的结果,眼睛或者粘膜的黑色素细胞簇,风头甚是红火,首个BRAF抑制剂Vemurafenib于2011年上市用于治疗黑色素瘤,靶向治疗药物
过去10年研究者们发现了多种基因的突变在与黑色素瘤的发病过程关系紧密。










